Nuevos métodos sintéticos derivados del enfoque solvotérmico, como los procesos ionotérmicos, se han utilizado para obtener nanopolvos de LiMPO4 (M= Mn, Co y Ni), LixMSiO4 [Nytén, A. et al. (2005)] y materiales de batería de fluorofosfatos de Li y Na [DiSalvo, FJ et al.
(1971); Ellis, BL y cols. (2007b)] utilizando baja temperatura de calentamiento. La síntesis ionotérmica surgió cuando una gran cantidad de trabajo de investigación se dirige a nuevos procesos de bajo costo para fabricar materiales de electrodos altamente optimizados electroquímicamente. Esta ruta alternativa se considera un nuevo proceso de síntesis de bajo costo porque demanda mucha menos energía que las rutas cerámicas de alta temperatura. A pesar del mayor coste de los líquidos iónicos en comparación con el agua, se ha demostrado que estos disolventes pueden reutilizarse sin purificación cuando se utilizan para preparar el mismo material, lo que conlleva una importante disminución de costes y minimiza la producción de residuos [Tarascon, JM. et al. (2010)]. La síntesis ionotérmica también se ha llevado a cabo con éxito utilizando microondas en lugar del calentamiento tradicional, lo que reduce el tiempo de reacción y la energía necesaria para la síntesis.
La síntesis ionotérmica se basa en el uso de un líquido iónico como medio de reacción en lugar de agua en condiciones solvotermales. Los líquidos iónicos son una clase de disolventes orgánicos con alta polaridad y una estructura de disolvente preorganizada [Del Popolo, MG y Voth, GA (2004)]. Los líquidos iónicos a temperatura ambiente (o casi a temperatura ambiente) se definen clásicamente como líquidos a temperatura ambiente (o <100 °C) que están compuestos de cationes y aniones orgánicos.
Tienen excelentes propiedades solvatantes, poca presión de vapor mensurable y alta estabilidad térmica. Las propiedades de solvatación y las temperaturas de fusión dependerán de la combinación de cationes y aniones elegidos. En el área de la ciencia de materiales, ha habido varios informes sobre el uso de líquidos iónicos como disolventes con muy poca o controlada cantidad de agua involucrada en la síntesis [Antonietti, M et al. (2004)]. La mayoría de estos estudios se concentraron en materiales amorfos y nanomateriales.
Al igual que el agua, los líquidos iónicos resultantes de pares catiónicos/aniónicos compatibles tienen excelentes propiedades disolventes. Además, poseen una alta estabilidad térmica y una volatilidad insignificante por lo que no es obligatorio el uso de autoclave. Además, debido a la naturaleza flexible de los pares catiónico/aniónico, presentan, como disolventes, grandes oportunidades para dirigir intencionadamente la nucleación. Durante la última década, la síntesis ionotérmica se ha convertido en una técnica sintética ventajosa para la preparación de zeotipos [Lin, ZJ. et al. (2008)] y otros materiales porosos como los compuestos estructurales organometálicos (MOF), pero se ha hecho un uso muy limitado de esta técnica en la síntesis de compuestos inorgánicos.
La característica única de la síntesis ionotérmica es que el líquido iónico actúa como disolvente y como proveedor de plantilla. Muchos cationes de líquidos iónicos son químicamente muy similares a especies que ya se conocen como buenos patrones (líquidos iónicos a base de alquilimidazolio y piridinio). Muchos son disolventes relativamente polares, lo que los hace adecuados para la disolución de los componentes inorgánicos necesarios para la síntesis. Una de las propiedades definitorias de los líquidos iónicos es su falta de una presión de vapor detectable, lo que efectivamente resulta en la eliminación de los problemas de seguridad asociados con las altas presiones hidrotermales y también ha llevado a su uso en la síntesis de microondas.
En el proceso de ruta ionotérmica, dado que no se agregan otros solventes a la mezcla de reacción, la teoría sostiene que no hay otras moléculas presentes que actúen como rellenos de espacio durante la síntesis. Esto significa que el método ionotérmico elimina idealmente la competencia entre las interacciones plantilla-estructura y disolvente-estructura que están presentes en las preparaciones hidrotermales. Este, sin embargo, es el escenario idealista, que no siempre es alcanzable debido a la posible descomposición de una pequeña fracción de los cationes líquidos iónicos, lo que da como resultado cationes plantilla más pequeños que pueden actuar preferentemente como agente director de estructura en el disolvente líquido iónico [Parnham , ER y Morris, RE (2006)].
Estudios recientes de modelado molecular indican que las estructuras de los líquidos iónicos se caracterizan por correlaciones y distribuciones de largo alcance que reflejan las estructuras asimétricas de los cationes. Los efectos asimétricos de largo alcance de este tipo aumentan potencialmente la probabilidad de transferir información química del catión plantilla a la estructura, una situación deseable si se quiere lograr un control total sobre el proceso de creación de plantillas [Parnham, ER y Morris, RE (2007) )].
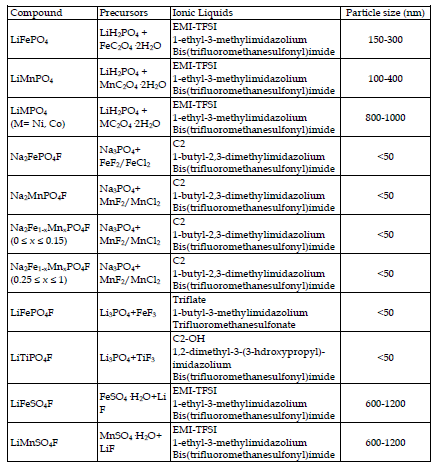
Tarascón et al. Fueron los primeros en aplicar la síntesis ionotérmica a los materiales de los electrodos de las baterías. Probaron varios líquidos iónicos basados en diferentes especies catiónicas y aniónicas como medio de reacción para la preparación de la fase LiFePO4 [Recham, N. et al. (2009a)]. Los líquidos iónicos utilizados demostraron tener un impacto en la nucleación/crecimiento de LiFePO4 y comportarse como un agente director estructural. Por ejemplo, el uso de un líquido iónico EMI-TFSI funcionalizado con CN [bis(trifluorometanosulfonil)imida de 1-etil-3-metilimidazolio] produjo polvos en forma de aguja a lo largo de la dirección [010] que se apilaron perfectamente para formar una aguja más grande. Este cambio en el grupo terminal modificó el carácter polar del medio reactivo y sus propiedades solvatantes, influyendo así en el crecimiento del cristal. Las partículas similares a plaquetas a lo largo de la dirección [020] se crearon disminuyendo la polaridad mediante el uso de un catión EMI basado en C18. La formación de estos
dos tipos morfológicos se puede explicar en términos de superficies energéticas en competencia y está directamente relacionada con la naturaleza del líquido iónico, el poder solvatante, la polaridad y la capacidad de absorber específicamente en una de las superficies. Dependiendo de las propiedades del líquido iónico, la minimización de la energía superficial del sistema se llevará a cabo mediante un mecanismo diferente. Todos los materiales producidos por LiFePO4 fueron electroquímicamente activos, pero los que tuvieron el mejor rendimiento fueron los de 300 y 500 nm de tamaño, mostrando una capacidad específica de 150 mAh·g-1 a C/10 sin recubrimiento de carbono.
El proceso ionotérmico se extendió a la síntesis de fluorofosfatos basados en Na de tamaño controlado [Na2MPO4F (M= Fe, Mn)] [Recham, N. et al. (2009b)]. Estas fases son materiales de electrodos atractivos porque se basan en metales económicos y pueden usarse tanto en baterías de Li como de Na. Además, los fluoruros poseen una mayor electronegatividad, lo que aumenta la ionicidad de los enlaces y, por tanto, sus potenciales redox debido al efecto inductivo. Se prepararon muestras de tamaño nanométrico de Na2FePO4F y Na2MnPO4F de aproximadamente 25 nm de diámetro en un líquido iónico de bis (trifluorometanosulfonil imida) de 1,2-dimetil-3-butilimidazolio, en contraste con los polvos gruesos obtenidos por el método cerámico. El rendimiento electroquímico del compuesto de hierro alcanzó mejores resultados que el del material cerámico, con 115 mAh·g-1, mejor capacidad inicial, menor capacidad irreversible, menor polarización y mejor retención de capacidad. La fase de manganeso no mostró actividad electroquímica, lo que sigue la tendencia general de los compuestos a base de Mn que tienen un peor rendimiento electroquímico que su contraparte de Fe, por ejemplo en las familias LiMPO4 y Li2MSiO4. Hay dos factores relacionados con este fenómeno. En primer lugar, la fuerte distorsión de Jahn-Teller sobre Mn3+, que afecta a su esfera de coordinación; y, en segundo lugar, la mala conductividad electrónico-iónica de los materiales, debido a la mayor ionicidad del enlace MO.
El proceso ionotérmico se ha utilizado con éxito para preparar nuevos materiales electroactivos que no se habían logrado antes, como el LiFeSO4F. Este material posee una estructura adecuada para favorecer la migración de iones Li a lo largo de los canales. Esta fase electroactiva no había sido sintetizada antes porque no es accesible ni mediante proceso cerámico ni en medio acuoso. Se descompone a temperaturas superiores a 375º C y en medio acuoso. Este nuevo material catódico mostró actividad electroquímica a 3,6 V y una capacidad específica reversible de 140 mAh·g-1, muy cercana al valor de capacidad específica teórica de 151 mAh·g-1. Por tanto, este proceso preparativo ha demostrado ser una herramienta útil para sintetizar materiales electroactivos nanométricos nuevos y conocidos.
 español
español  English
English français
français Deutsch
Deutsch русский
русский italiano
italiano español
español 日本語
日本語 Polski
Polski svenska
svenska 中文
中文









 IPv6 red compatible
IPv6 red compatible